De la recherche à l’achat durable des dispositifs médicaux : avancée et rebondissement dans la lutte contre les substances CMR et PE
Lucie Germon, pharmacien hospitalier, CHU de Clermont-Ferrand, coordinatrice du groupement d’achat PharmAuvergne
Le sujet de la teneur en substances cancérigènes, mutagènes et reprotoxiques (CMR)1 et des substances présentant des propriétés perturbant le système endocrinien (PE)2 dans les produits de santé a pris de l’ampleur ces dernières années et fait régulièrement l’actualité. Ces substances dangereuses provoquent des troubles affectant les hormones sexuelles3, métaboliques4, neurodéveloppementaux et du comportement5, avec des liens substances-effets complexes, des courbes doses-effets non monotones et des effets « cocktails ». Les nouveaux nés et les femmes enceintes sont identifiés comme des populations particulièrement à risque.
Dans le domaine médical, les dispositifs médicaux utilisés dans les soins sont une source d’explosion pour les patients. Depuis plusieurs années le CHU de Clermont-Ferrand est porteur de projets de recherche visant à étudier le risque d’exposition des patients hospitalisés aux composés CMR et PE (ARMED, ARMED NEO, études sur les plastifiants6. Les résultats obtenus7 mettent en évidence une surexposition des nouveau-nés en réanimation à certains phtalates via les DM en polychlorure de vinyle (PVC) plastifié, avec des impacts cliniques à court ou long terme difficiles à évaluer.
Le nouveau règlement européen relative à l’autorisation de commercialisation des DM (UE) 2017/745 a pour but l’amélioration de la sécurité des dispositifs médicaux8. Ainsi, certaines exigences concernent les substances CMR et PE entrant dans la conception et la fabrication des DM. Cependant, les exigences du règlement européen constituent un premier jalon encore insuffisant en regard des effets connus des CMR et PE en cela qu’il n’annonce qu’une limite de pourcentage en masse par substances (0,1%).
L’une des solutions proposées en conclusion des travaux d’ARMED/ARMED NEO pour la réduction du risque de l’exposition des patients à ces composés est d’agir dès le choix de référencement des DM utilisés.
Les achats sont gérés à la Pharmacie à Usage Intérieur du CHU par la coordination du groupement PharmAuvergne pour l’achat des DMS, sous délégation du Directeur général, pour les besoins de 33 établissements sur trois GHT. Ainsi, la politique achat vis-à-vis des CMR et PE rayonne sur la région entière, afin de faire progresser ensemble tous les établissements sur cette thématique.
En considérant les obligations des marchés publics (9), la concrétisation des résultats de l’équipe de recherche sur les CMR et PE peut se faire au travers des appels d’offres (AO), en modifiant les critères de jugement des offres notamment. Une première expérience réalisé en 2019 lors d’un appel d’offres précédent du groupement avait consacré une partie du cahier des clauses techniques particulières aux CMR et PE, afin d’évaluer les capacités des fournisseurs pour intégrer les données CMR/PE dans les choix.
Poursuivant ces efforts, une nouvelle démarche d’achat a été engagée par le groupement en 2020-2021 afin d’être encore plus incisif dans la sensibilisation des opérateurs économiques et les choix de marché. Un travail de plusieurs mois a permis de développer une méthodologie d’évaluation des CMR et PE transposable au cadre juridique strict des AO, reposant sur l’obtention et l’analyse de données pertinentes et exploitables de la part des fabricants. Le but est d’évaluer la performance de l’offre des candidats en termes de teneur en CMR et PE et leur capacité à mesurer et maitriser cette teneur. Avec la mise au point d’une grille de recueil et d’un barème de notation, une phase de test a été mise en œuvre auprès d’une trentaine d’opérateurs économiques (OE) en mimant les conditions d’un véritable appel d’offre.
À l’issue de cette mission, le groupe de travail a produit un critère, une méthode et des notations réelles à partir des données des OE. Les constats faits sont très préoccupants.
D’une partie, la qualité de réponse des OE a été jugée très peu satisfaisante (figure 1).
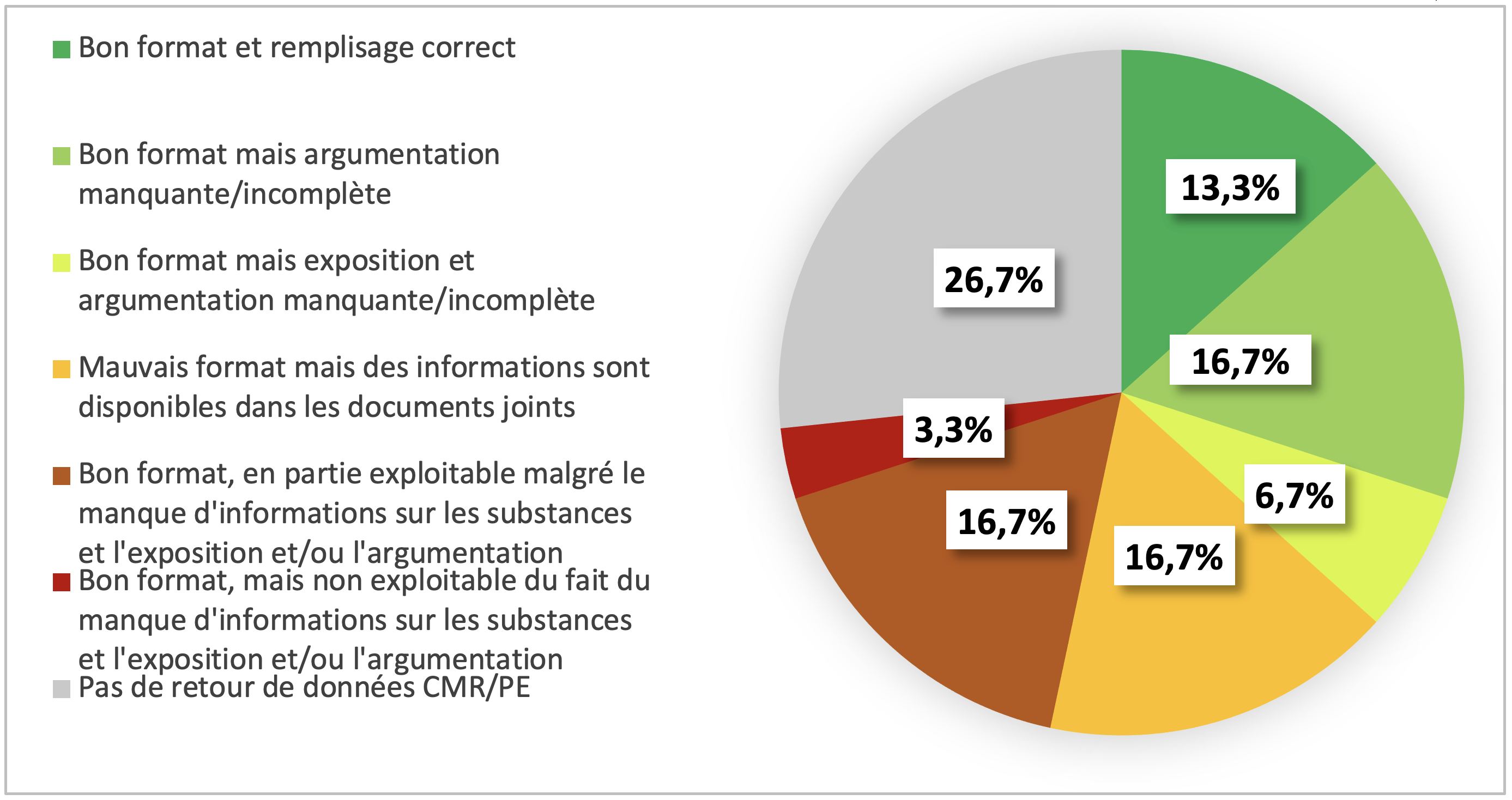
Figure 1 : qualité des réponses fournisseur à la grille de recueil de données CMR et PE
Sur les 30 candidats sondés, 8 (26,7%) n’ont transmis aucune information concernant les substances CMR et perturbateurs endocriniens. Les motifs expliquant cette absence de réponse sont : absence d’explication ou de motif concernant l’absence de réponse ; demande en dehors des priorités actuelles de la société car renouvellement de marquage CE est privilégié ; informations difficiles à obtenir car la demande est une nouveauté ou les services en charge du dossier ne donnent pas de retour (siège de l’entreprise hors France, site de production distinct du fournisseur du CHU). In fine, seule 13,3% des réponses étaient complètes.
D’autres parts, pour ce qui est des compositions en CMR et PE, les substances déclarées / non déclarées sont présentées dans la figure 2 suivante :
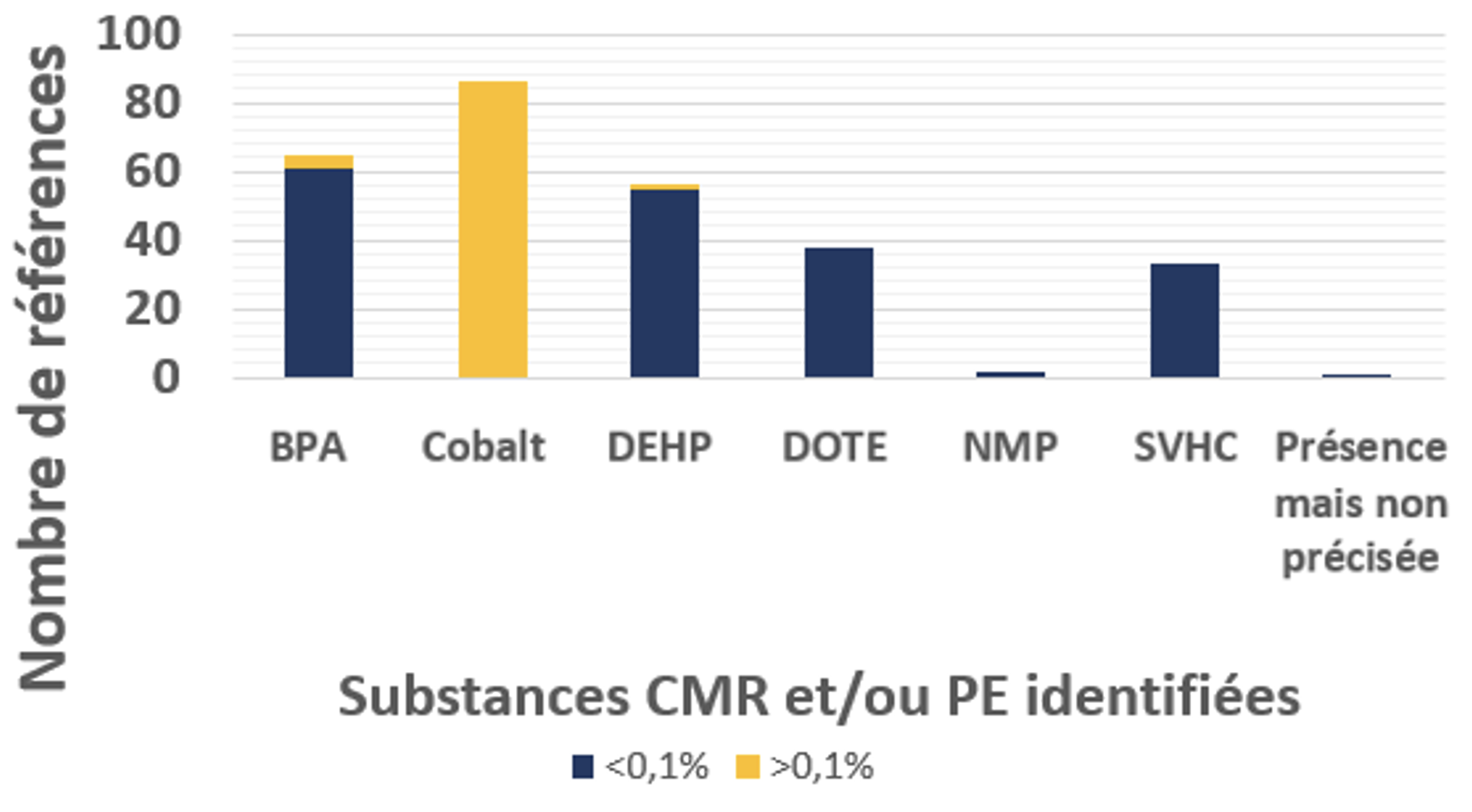
Figure 2 : substances déclarées / non déclarées en CMR et PE par les OE
Les réponses des OE amènent les constats suivants :
- 93,2% des références de DMS proposés dans le cadre des marchés ont au moins une substance CMR/PE déclarée ;
- Une relance a été systématiquement nécessaire pour la prise en compte de l’oxyde d’éthylène, qui est un mode de stérilisation très banalisé alors qu’il s’agit une substance considérée comme CMR de classe 1B (Substances dont le potentiel cancérogène pour l’être humain est supposé);
- Les substances avec une teneur en masse < 0,1% ne sont pas systématiquement prises en compte au motif du règlement européen ; tandis que des effets PE soient présents en dessous de ce seuil.
L’exposition est indéniable, mais discriminer les différentes offres pour un même lot est complexe car il apparait que les données fournis par les OE sont peu matures, avec des doutes émis sur leur fiabilité. L’organisation d’un contrôle analytique qualitatif et quantitatif sur les DMS à la recherche de substances CMR et PE est apparue nécessaire. Dotés des compétences adéquates, la plateforme d’évaluation des DM de la Pharmacie du CHU montera en charge pour les réaliser, et permettra également de constituer une banque de données par référence.
Ces trop nombreuses défaillances sur des données primaires rendent inappropriée la prise en compte du problème des CMR/PE sous forme d’un critère conventionnel de jugement des offres. Le résultat risque d’être peu fiable ou peu discriminant ou éjectant OE de la mise en concurrence pour des raisons de délais ou de format de réponses. Cela constituerait à la fois un échec méthodologique et une perte de chance pour le choix d’un DM performant.
Le groupe de travail a donc statué sur un changement de méthodologie : l’évaluation CMR/PE devient une clause d’exécution pour les titulaires des marchés du groupement PharmAuvergne et pourra être un motif de résiliation du marché. La clause est appliquée à des lots stratégiques de perfusion, d’abord respiratoire, de drainage, etc.
La mise en œuvre des conclusions de l’équipe de recherche est le fruit de l’étroite collaboration entre pharmaciens chercheurs et pharmaciens acheteurs hospitaliers. Les défaillances de mises à disposition des informations scientifiques par les OE a constitué un obstacle inattendu dans le déroulement du projet, et témoignent sans doute du peu de recul dans l’application du nouveau règlement européen 2017/745, dont les exigences restent hélas faibles vis-à-vis des risques liés à ces substances. De ce travail et de son dénouement final, il ressort que la sensibilisation des OE et différents acteurs sur la problématique des CMR/PE est insuffisante.
Au travers de démarches impactant les marchés hospitaliers, les efforts sont à poursuivre pour une meilleure prise de conscience sur ces expositions aux substances CMR et PE dans les produits de santé à destination des populations à risques, et pour encourager la recherche d’alternatives en lien avec les utilisateurs et les OE.
Le CHU de Clermont-Ferrand se positionne aujourd’hui comme acteur dynamique dans l’évaluation du risque CMR et PE par la mise en œuvre d’actions concrètes, la montée en compétences d’analyse de données et en développant ses capacités à réaliser le dosage des substances.
Références
- Règlement (CE) n°1272/2008 du Parlement européen et du Conseil du 16 décembre 2008 relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges, modifiant et abrogeant les directives 67/548/CEE et 1999/45/CE et modifiant le règlement (CE) n°1907/2006. Union Européenne; 2008 déc. Report No.: 1272/2008.
- Avis relatif à la définition de critères scientifiques définissant les perturbateurs endocriniens. Agence Nationale de Sécurité Sanitaire de l’alimentation, de l’environnement et du travail; 2016 juill. Report No.: 2016-SA-0133.
- Complications liées à l’exposition in utero au diéthylstilbestrol (DES) – (Distilbène®, Stilboestrol-Borne®) [Internet]. Agence Nationale de Sécurité du Médicament et des produits de santé; 2011 juin. Disponible sur: https://ansm.sante.fr/documents/reference/recommandations-pour-les-medicaments
- Wassenaar PNH, Trasande L, Legler J. Systematic Review and Meta-Analysis of Early-Life Exposure to Bisphenol A and Obesity-Related Outcomes in Rodents. Environ Health Perspect. 3 oct 2017;125(10):106001.
- Demeneix B, Henry J. Cocktail toxique: comment les perturbateurs endocriniens empoisonnent notre cerveau. 2017.
- 2012 – 2016 : 5 années d’appels à projets de recherche [Internet]. Agence Nationale de Sécurité du Médicament et des produits de santé; 2017 juin. Disponible sur: https://archiveansm.integra.fr/var/ansm_site/storage/original/application/5b24229a0b5ce40675a00553ece54a0d.pdf
- Bernard L, Bouattour Y, Masse M, Boeuf B, Decaudin B, Genay S, et al. Association between Urinary Metabolites and the Exposure of Intensive Care Newborns to Plasticizers of Medical Devices Used for Their Care Management. Metabolites. 19 avr 2021;11(4):252.
- Règlement (UE) 2017/745 du Parlement Européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux. Union Européenne; 2017 avr. Report No.: 2017/745.
- Ordonnance n° 2018-1074 du 26 novembre 2018 portant partie législative du code de la commande publique.

Comment mener une opération « green bloc » : l’exemple du CHU de Strasbourg
La démarche « green bloc » au CHU de Strasbourg commence en septembre 2017, lorsque l’équipe d’anesthésie réanimation revient du Congrès annuel de la SFAR. Lors d’une présentation du Comité Développement Durable, le Dr Jane Muret expose plusieurs possibilités d’amélioration de nos pratiques au bloc opératoire à la lumière des trois piliers du développement durable : écologique, économique et social.

